
Los biomarcadores en psiquiatría han ganado atención en las últimas décadas como una forma prometedora de mejorar el diagnóstico y tratamiento de los trastornos mentales graves. Estos marcadores, que incluyen proteínas, genes, y moléculas inflamatorias, pueden proporcionar una ventana objetiva hacia la fisiopatología subyacente de trastornos mentales graves como la depresión, la esquizofrenia, y los trastornos del espectro autista. El objetivo principal del uso de estas moléculas es identificar biomarcadores que mejoren la precisión del diagnóstico, predicen la respuesta al tratamiento y establezcan estrategias de tratamiento personalizadas (Ilu.1). En psiquiatría, estos marcadores tienen el potencial de clarificar las diferencias subyacentes entre individuos con el mismo diagnóstico clínico, lo que permitiría avanzar hacía una medicina personalizada con un enfoque más específico en el tratamiento de cada paciente.
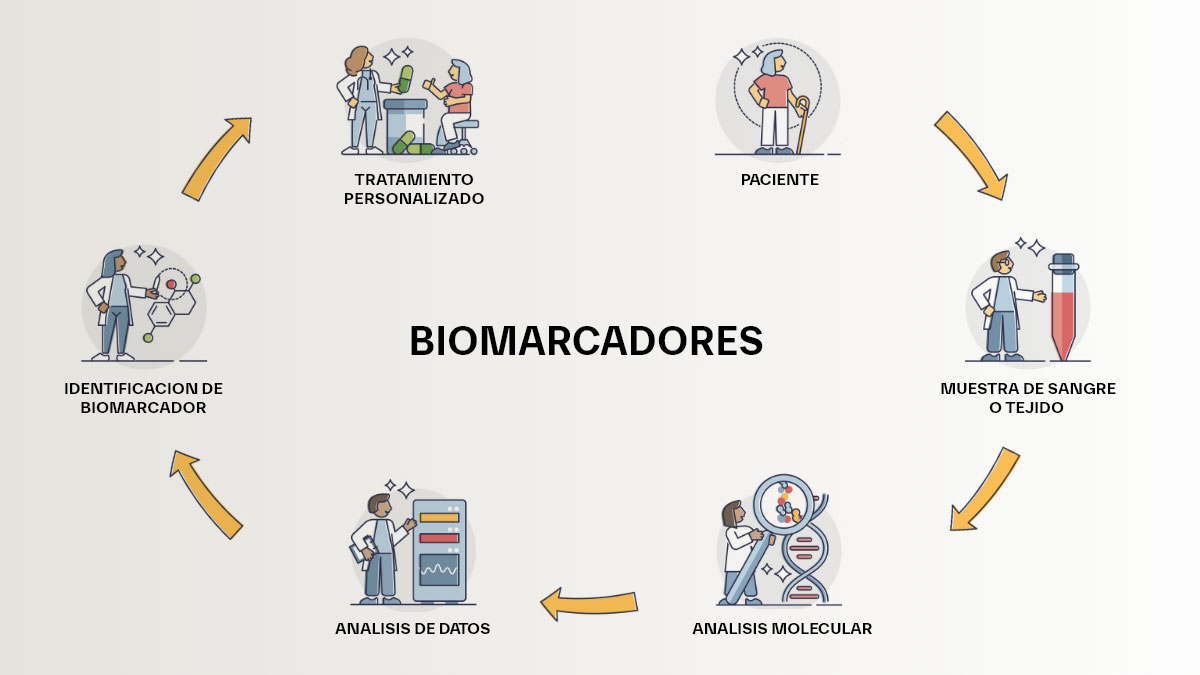
Ilustración 1: Pasos del uso de biomarcadores para establecer una atención personalizada al paciente 1.
(Imagen adaptada al español de la original de www.kaleidoscopefightinglupus.org)
En las últimas décadas, el desarrollo de terapias eficaces para mejorar el rendimiento cognitivo se ha centrado en la búsqueda de fármacos inmunomoduladores o antiinflamatorios. El papel de la inflamación en los trastornos psiquiátricos ha sido objeto de un creciente interés. Estudios han demostrado que los niveles elevados de citoquinas proinflamatorias, como la interleucina-6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α), se asocian con síntomas más severos de depresión y ansiedad2. Estas moléculas también se han correlacionado con la resistencia al tratamiento en la depresión mayor y también pueden desempeñar un papel fundamental en la regulación de las características biológicas a nivel molecular, como la plasticidad sináptica, la neurogénesis y la neuromodulación3. Por lo tanto, su uso ayudará a establecer pronósticos en la evaluación de la enfermedad4.
Entre los más estudiados biomarcadores se encuentran los factores neurotróficos, particularmente el factor neurotrófico derivado del cerebro (BDNF), que ha mostrado niveles reducidos en individuos con depresión y se ha correlacionado con la respuesta positiva al tratamiento antidepresivo2,3.
Polimorfismos en genes relacionados con el sistema dopaminérgico y glutamatérgico, como el gen del receptor de dopamina D2 (DRD2), han sido identificados como factores de riesgo en esquizofrenia5. Además, estudios epigenéticos han revelado que las modificaciones en la metilación del ADN pueden alterar la expresión de genes clave, influyendo en la susceptibilidad al trastorno7. En este contexto, la genética molecular, el análisis de plasma y líquido cefalorraquídeo, y la neuroimagen estructural y funcional se consideran campos atractivos y prometedores en la investigación centrada en biomarcadores2.
También existen biomarcadores metabólicos que están relacionados con trastornos mentales graves. El ácido araquidónico, un tipo de grasa poliinsaturada omega-6, y el ácido docosahexaenoico, un tipo de grasa poliinsaturada omega-3, están relacionados de forma adversa con los síntomas negativos en pacientes con esquizofrenia. Además, el tratamiento antipsicótico parece aumentar los niveles de estas grasas. Según estudios, los triglicéridos y el colesterol HDL podrían ser los dos componentes lipídicos principales involucrados en el desarrollo de la esquizofrenia y los síntomas negativos. Se observa una relación negativa entre la sintomatología negativa y los triglicéridos, mientras que hay una relación positiva con el colesterol HDL8. Otro estudio reveló que niveles elevados de triglicéridos y colesterol total están asociados con una disminución en los síntomas negativos. Además, los síntomas negativos están correlacionados de forma negativa con el índice de masa corporal (IMC). También se ha observado una mayor prevalencia del síndrome metabólico en pacientes con esquizofrenia que presentan sintomatología negativa9.
El estrés oxidativo es un proceso en el cuerpo que puede dañar nuestras células y contribuir al desarrollo de enfermedades. Algunos estudios han demostrado que los niveles periféricos de los parámetros de estrés oxidativo son diferentes en pacientes con esquizofrenia en comparación con personas sanas. En particular, se ha observado que los niveles de estrés oxidativo en pacientes ambulatorios estabilizados durante los primeros 10 años de evolución de la esquizofrenia son distintos a los de las personas sanas que se utilizaron como grupo de control10. Esto sugiere que los biomarcadores relacionados con el estrés oxidativo podrían estar asociados con las diferentes dimensiones clínicas de la esquizofrenia, es decir, los síntomas y características específicas de la enfermedad. Estos hallazgos son importantes ya que pueden ayudar a comprender mejor la esquizofrenia y desarrollar nuevas estrategias de tratamiento. Sin embargo, es necesario realizar más investigaciones para confirmar y comprender completamente estas asociaciones.
A pesar del potencial en el diagnóstico y el tratamiento de los biomarcadores en psiquiatría, la implementación clínica todavía enfrenta varios desafíos. Los estudios tienden a ser inconsistentes, y muchos biomarcadores no se replican entre diferentes cohortes. Las causas de esta variabilidad incluyen factores como el entorno, la comorbilidad con otros trastornos y sus tratamientos, y la heterogeneidad biológica dentro de los mismos diagnósticos. A medida que se realizan estudios más grandes y más integrados, hay esperanzas de que los biomarcadores se conviertan en herramientas diagnósticas y pronósticas fiables.
Referencias:
DOC.4000.102024